Полудесмосома обеспечивает прикрепление клетки к базальной мембране (например, кератиноцитов базального слоя эпидермиса, миоэпителиальных клеток). Полудесмосома, как и десмосома, содержит цитоплазматическую пластинку с вплетёнными в неё промежуточными филаментами. Особенность состава цитоплазматической пластинки - наличие пемфигоидного Аг.
Плотный контакт
Плотный контакт формирует в различных клеточных слоях регулируемый барьер проницаемости, разделяющий разные по химическому составу среды (например, внутреннюю и внешнюю), обеспечивает полярное распределение мембранных молекул на апикальной и базолатеральной сторонах клеток.
Структура. Плотный контакт состоит из непрерывных цепочек трансмембранных белковых молекул окклюдина и клаудина, соединяющих плазматические мембраны соседних клеток. Цитоплазматический домен окклюдина через белки zonula occludens ZO-1, ZO-2 и ZO-З связан с актином кортикального цитоскелета.
Проницаемость. Некоторые лиганды влияют на проницаемость контакта. Например, в ответ на гистамин эндотелиальные клетки в результате взаимодействия актиновых и миозиновых филаментов отделяются друг от друга, приобретают округлую форму, увеличивая проницаемость сосуда.
Примеры: наружные клетки морулы и клетки трофобласта, каёмчатые клетки эпителия кишки, эндотелий капилляров, периневральные клетки, альвеолоциты, эпителиальные клетки почечных канальцев.
Коммуникационные контакты
Контакты этого типа - щелевые и синапсы.
Щелевой контакт
Щелевой контакт обеспечивает ионное и метаболическое сопряжение клеток. Плазматические мембраны клеток, образующих щелевой контакт, разделены щелью шириной 2-4 нм. Коннексон - трансмембранный белок цилиндрической конфигурации; состоит из 6 СЕ коннексина. Два коннексона соседних клеток соединяются в межмембранном пространстве и образуют канал между клетками. Канал коннексона диаметром 1,5 нм пропускает ионы и молекулы с М г до 1,5 кД. Известно несколько коннексинов. Коннексин-43 экспрессируют кардиомиоциты, особенно важен при развитии миокарда. Коннексин-32 входит в состав щелевых контактов между гепатоцитами, шванновскими клетками. Коннексин-37 экспрессируют клетки различных тканей и органов, включая сердце, матку, яичник, эндотелиальные клетки кровеносных сосудов.
Функция. Через щелевые контакты проходят низкомолекулярные вещества, регулирующие рост и развитие клеток. Для клеток нейроглии щелевой контакт имеет важное значение в регуляции уровня внутриклеточного Са 2+ . Щелевые контакты обеспечивают распространение возбуждения - переход ионов между мышечными клетками миокарда и между ГМК.
Синапс
Синапс - специализированный межклеточный контакт, обеспечивает передачу сигналов с одной клетки на другую. Сигнальная молекула - нейромедиатор. Синапсы формируют клетки возбудимых тканей (нервные клетки между собой, нервные клетки и мышечные волокна (нервно-мышечный синапс). В синапсе различают пресинаптическую часть, постсинаптическую часть и расположенную между клетками синаптическую щель.
Гибель клеток
Развитие многоклеточного организма, формирование тканей и их функционирование предполагают наличие баланса между клеточной пролиферацией, клеточной дифференцировкой и гибелью клеток. Клетки гибнут в различных ситуациях, как нормальных, так и патологических. Так, массовую гибель клеток в раннем онтогенезе называют запрограммированной. Клетки, выполнившие свои функции, погибают в течение всей жизни организма. Наконец, клетки гибнут при повреждении и некрозе ткани, а также при различных заболеваниях, избирательно поражающих отдельные типы клеток (дегенерация).
Запрограммированная гибель клеток - естественный процесс массовой гибели клеток и элиминации целых клонов в ходе эмбрионального развития, гистогенеза и морфогенеза органов. В данном случае речь идёт о гибели клеток, не достигших состояния терминальной дифференцировки. Примером служит запрограммированная гибель нейробластов (от 25 до 75%) на определённых этапах развития мозга. Запрограммированная гибель клеток реализуется путём апоптоза.
Гибель клеток, выполнивших свою функцию, наблюдают при удалении клонов иммунокомпетентных клеток при иммунном ответе. Эозинофилы погибают после дегрануляции. Клетки, выполнившие свою функцию, гибнут путём апоптоза. Механизм гибели клеток, достигших состояния терминальной дифференцировки и выполнивших свою функцию, изучен недостаточно, но ясно, что он генетически детерминирован. Так, экспрессия гена fos служит маркёром терминальной дифференцировки и одновременно предшествует гибели клеток.
Некроз - гибель клеток вследствие повреждения. Некроз - всегда патологическая ситуация. Механизмы некроза иные, чем при апоптозе. Некроз индуцируется физическими и химическими агентами и характеризуется нарушением целостности мембран, набуханием клетки и ядра, неупорядоченной деградацией ДНК, деструкцией органелл и местным воспалением.
Дегенерация. При некоторых патологических состояниях наблюдают относительно избирательную гибель клеток, например, в нервной системе при боковом амиотрофическом склерозе (болезнь Шарко) и болезни Альцхаймера.
Информационные межклеточные взаимодействия укладываются в схему, предусматривающую следующую последовательность событий:
Сигнал → рецептор → (второй посредник) → ответ
Сигналы. Передачу сигналов от клетки к клетке осуществляют сигнальные молекулы (первый посредник), вырабатываемые в одних клетках и специфически воздействующие на другие клетки – клетки-мишени. Специфичность воздействия сигнальных молекул определяют присутствующие в клетках-мишенях рецепторы, связывающие только собственные лиганды. Все сигнальные молекулы (лиганды) – в зависимости от их физико-химической природы – подразделяют на полярные (точнее – гидрофильные) и аполярные (точнее – жирорастворимые).
Рецепторы регистрируют поступающий к клетке сигнал и передают его вторым посредникам. Различают мембранные и ядерные рецепторы.
Мембранные рецепторы – гликопротеины. Они контролируют проницаемость плазмолеммы путем изменения конформации белков ионных каналов (например, н-холинорецептор), регулируют поступление молекул в клетку (например, холестерина), связывают молекулы внеклеточного вещества с элементами цитоскелета (например, интегрины), регистрируют присутствие информационных сигналов (например, нейромедиаторов, квантов света, обонятельных молекул, антигенов, цитокинов, гормонов пептидной природы). Мембранные рецепторы регистрируют поступающий к клетке сигнал и передают его внутриклеточным химическим соединениям, опосредующим конечный эффект (вторые посредники ). Функционально мембранные рецепторы подразделяют на каталитические, связанные с ионными каналами и оперирующие через G-белок.
Ядерные рецепторы – белки-рецепторы стероидных гормонов (минерально- и глюкокортикоиды, эстрогены, прогестерон, тестостерон), ретиноидов, тиреоидных гормонов, желчных кислот, витамина D 3 ,. Каждый рецептор имеет область связывания лиганда и участок, взаимодействующий со специфическими последовательностями ДНК. Другими словами, ядерные рецепторы – активируемые лигандом транскриптиционные факторы. В геноме человека имеется более 30 ядерных рецепторов, лиганды которых находятся на стадии идентификации (сиротские рецепторы).
Внерецепторные низкомолекулярные сигналы. Некоторые низкомолекулярные сигналы (например, оксид азота и монооксид углерода) воздействуют на клетку-мишень, минуя рецепторы.
Оксид азота (NO ) – газообразный медиатор межклеточных взаимодействий, образуется из L-аргинина при участии фермента NO-синтазы. В клетках-мишенях активирует гуанилатциклазу, что приводит к увеличению уровня второго посредника – цГМФ.
Монооксид углерода (угарный газ, СО). Как сигнальная молекула СОиграет важную роль в иммунной, сердечно-сосудистой системах и периферической нервной системе.
Вторые посредники. Внутриклеточныесигнальные молекулы (вторые посредники) передают информацию с мембранных рецепторов на эффекторы (исполнительные молекулы), опосредующие ответ клетки на сигнал. Стимулы, такие как свет, запах, гормоны и другие химические сигналы (лиганды), инициируют ответ клетки-мишени, изменяя в ней уровень внутриклеточных вторых посредников. Вторые (внутриклеточные) посредники представлены многочисленным классом соединений. К ним относятся циклические нуклеотиды (цАМФ и цГМФ), инозитолтрифосфат, диацилглицерол, Са 2+ .
Ответы клеток-мишеней. Функции клеток выполняются на разных уровнях реализации генетической информации (например, транскрипция, посттрансляционная модификация) и крайне разнообразны (например, изменения режима функционирования, стимуляция или подавление активности, перепрограммирование синтезов и так далее).
Взаимодействие между, клетками в ткани и соединение различных тканей в организме обеспечивается немембранными структурами, которые называются базальными пластинками. Эти, структуры подставляют собой как бы основу, которая скрепляет клетки и удерживает их вместе.
Несмотря на некоторое функциональное сходство с мембранами, базальные пластинки все-таки нельзя причислить к мембранам хотя бы потому, что они не содержат липидов и не являются непроницаемым барьером для веществ и ионов. Базальные пластинки состоят из полисахаридов, соединенных с белками. Благодаря своим свойствам: вязкости; способности образовывать гели и вызывать адгезию клеток - базальные пластинки не только связывают клетки друг с другом, но и способны поддерживать форму органа в целом.
Базальные пластинки имеют отчетливо выраженное ламеллярное волокнистое строение, напоминающее структуру мембран почечных канальцев, которые осуществляют фильтрацию. По химическому составу базальные мембраны близки к коллагену.
В их состав входят гликопротеины, содержащие дисахаридные цепи в спиральной части волокон и полисахаридные цепи в неспиральных участках. В отличие от коллагена базальные мембраны включают большое количество спиральных участков, S-S-связей и полисахаридных цепей.
Благодаря наличию специфических мест узнавания или изменению форм мембран в некоторых участках взаимодействия клеток внешняя поверхность цитоплазматических мембран многоклеточных организмов играет важную роль в создании межклеточных контактов. Этот термин рекомендуется употреблять в тех случаях, когда имеются промежутки между клеточными поверхностями, заполненные внеклеточным материалом. С целью уточнения механизмов взаимодействия близлежащих клеток используются также термины «межмембранное пространство», «парацеллюлярное пространство», «контактные комплексы».
Межклеточный контакт следует рассматривать как сложно организованную систему, состоящую из ряда специализированных элементов. Эти элементы четко идентифицируются с помощью электронной микроскопии, однако их номенклатура до настоящего времени достаточно не разработана. В различных тканях контакты, в зависимости от функционального назначения, могут включать и себя те или иные элементы. В настоящем разделе рассмотрены преимущественно межклеточные контакты эпителиоцитов, так как в состав этих контактов входят все известные типы специализированных элементов. К специализированным элементам межклеточных контактов относят: простое соединение, соединение типа «замка», плотное соединение, область слипания, щелевидное соединение, септированное соединение и лестничное соединение. В формировании этих элементов принимают участие все три компонента клеточной поверхности: надмембранный компонент, или гликокаліґкс, плазматическая мембрана и подмембранный компонент.
На рис. 6.2. показаны возможные места контактов между клетками эпителия тонкого кишечника. С помощью электронной микроскопии были обнаружены три типа контактных
Микроворсинки
align=right hspace=7>Плотный
Овальные
десмосомы
десмосомы
Базальная
пластинка
структур: плотный контакт, щелевой контакт и взаимодействие с помощью десмосом.
В зоне плотного контакта (tight junction) две плазматические мембраны полностью смыкаются, по при этом цитоплазматические пространства двух контактирующих клеток остаются отделенными друг от друга (рис. 6.3).
В таких контактах наружные участки мембран местами сливаются в общий слой толщиной 2-3 нм. Слияние наружных слоев мембран происходит не по всей площади плотного соединения, а представляет собой серии точечных слияний мембран. Эти точечные слияния, пересекаясь образуют сеть, располагающуюся »между апикальными краями контактирующих клеток.
На протяжении более чем ста лет термин «плотное соединение» использовался в качестве описательной системы для пространства контактирующих между собой двух клеток. Благодаря последним сорока годам исследований в данной области,
Цитоплазма
![]()
 Мембраны
Мембраны
Коннексиновый цилиндр
![]() а)
а)
Рис. 6.3. Схематическое изображение плотного контакта (а) и щелевого контакта (б)
паши воззрения на природу плотного контакта, как своего рода цементирующей массы, значительно изменились. Несмотря на го, что наши знания о строении и функции этого образования еще далеки от идеальных, тем не менее уже сейчас достаточно данных, свидетельствующих о том, что это сложно организованная динамическая мультибелковая структура, избирательно проницаемая для определенных гидрофильных соединений (ионы, нутриенты, лекарства).
Морфологические особенности и регуляторные свойства плотного контакта, а также тот факт, что он является проницаемым для гидрофильных соединений незначительной молекулярной массы свидетельствуют об ограниченности просвета между двумя клетками. Существуют, по крайней мере, две гипотезы, объясняющие это явление. Первая, касается диаметра пор между контактирующими клетками. Так у энтероцитов человека они составляют 0,3-0,6 нм . Благодаря различному
размеру межклеточных пор, наблюдаемых вдоль кишечного тракта одного вида экспериментальных животных, а также их диаметра, обусловленного видом животного, скорости пара- целлюлярного переноса лекарств могут значительно колебаться. Так, например, антагонист Р-адренорецепторов атенолол (log D7a = - 1,9; молекулярная масса - 226) проявляет довольно высокую степень абсорбции в кишечнике собак (90 %) и только половину в организме крыс и человека .
Другой представитель этой группы - ксимотерол (log£)74 = = - 10; молекулярная масса - 339) имеет более низкие показатели (у собак 36 %, у крыс и человека соответственно 19 и 9 %).
Увеличение молекулярной массы, за счет присоединения соответствующих заместителей, в полиэтиленгликоле, кардинально меняло степень их парацеллюлярного транспорта. Варьирование молекулярной массой производных полиэтиленгли-, коля (281-591) уменьшало степень абсорбции веществ в кишечнике крыс от 79 до 2 %. Для организма собак, при использовании производных полиэтиленгликоля с молекулярными массами 600-900 этот показатель изменялся в интервале 100-13 %. Предполагается , что процессы, происходящие в организме крыс, в большей степени, напоминают аналогичные явления, наблюдаемые в организме человека.
Вторая гипотеза предполагает наличие между контактирующими клетками молекулярной структуры, управляющей проницаемостью щели (канала). В возбудимых мембранах при понижении покоя ниже определенной пороговой величины открываются каналы, по которым ион натрия поступает внутрь клетки. Предполагают, что в состоянии покоя в нервном волокне натриевые каналы закрыты воротами, которые открываются при деполяризации мембраны.
Иногда термин «ворота» применяют не только к каналу, но и к отдельному белку-каналоформеру. Например, на внутренней мембране митохондрий локализована Н+-АТФаза, формирующая канал проницаемости для ионов водорода, по которому они проникают с внутренней поверхности мембраны на наружную.
Наличие гипотетических ворот у контактирующих клеток должно быть отмечено присутствием в области плотного соединения специфических белков. В настоящее время установлено в этой области клеток существование целой группы трансмембранных и цитозольных белков, взаимодействующих не только между собой, но и со структурами цитоскелета.
Первым белком, который был изолирован из плотного контакта, а затем изучен является окклюдин. Его название, в переводе с английского (occludin), указывает на его запирающую (закрывающую) функцию.
Впервые окклюдин был обнаружен в гепатоцитах цыплят , а позже в различных клетках многих видов экспериментальных животных . Он относится к мембранным белкам и состоит из четырех доменов. Окклюдин выполняет двойную роль: 1) интеграция всех компонентов плотного контакта; 2) барьерная функция. При этом особое значение в перечисленных процессах имеют ЛЛконцевой участок молекулы окклюдина и его домены, расположенные на поверхности внешней мембраны клеток. Что касается С-концевого участка окклюдина, то ему отводится регуляторная роль, обусловленная его возможностью взаимодействовать с другими белками плотного контакта, которые в свою очередь связаны со структурами цитоскелета.
Таким образом, взаимодействие плотного соединения с цитоскелетом и способность окклюдина к фосфорилированию дают возможность выполнять этим белком регуляторные функции.
Недавно в плотном контакте обнаружено новое семейство специфических белков-окклюдинов. Эта группа белков подобна окклюдину и содержит четыре предполагаемых домена. К настоящему времени количество изученных клаудинов насчитывает 15 разновидностей . Экспрессия клаудинов 1 и 2 в фибробластах, у которых в норме отсутствуют эти белки, показала, что они, наряду с окклюдином, играют значительную роль в процессах парацеллюлярного транспорта (рис. 6.4).
Считается, что клаудины наряду с кадгеринами отвечают за формирование связи Между однотипными эндотелиальными клетками.
Кроме трансмембранных протеинов, структуру плотного контакта обеспечивают также три цитозольных белка. Они получили название белков, связанных с плотными соединениями (tight junction associated proteins - TJAPs).
Электронно-микроскопические исследования поверхности сколов замороженных тканей показывают, что в этой области клетки опоясаны лентой клеточного контакта иногда называемой «зоной слипания» (zonula occludens). Подмембранный компонент в ней представлен микрофиламентами диаметром 4-7 нм. Отсюда наименование трех представителей TJAPs (ZO-1, ZO-2 и ZO-3).
Первым из трех TJAPs был выделен и идентифицирован белок ZO-1 . Оказалось, что половина А-концевой части
молекулы ZO-1 взаимодействует с С-концевой частью окклюди- на, а вторая половина - с F-актином цитоскелета. Аналогично ведет себя и молекула ZO-2: половина ее А-концевой части взаимодействует с окклюдином, однако вторая - с А-концевым участком ZO-1. И, наконец, ZO-3 взаимодействует с окклюдином и ZO-1. Следовательно, во взаимодействии TJAPs возможны только два комплекса (ZO-1-ZO-2 и ZO-1-ZO-3). Тройственный комплекс в этой системе возникать не может, так как не возникает взаимодействие ZO-2-ZO-3.
Взаимосвязь отдельных компонентов (белков) в составе плотного контакта соседних клеток представлена на рисунке 6.4 148].
Если плотный контакт действительно может избирательно пропускать необходимые молекулы, то этот процесс должен определенным образом регулироваться. Как и во всех иных биологических процессах это могут быть физиологическая, клеточная или молекулярная регуляции. Основным показателем этого явления считается напряженность (диффузионное сопротивление) плотного соединения, изменение силы которой влечет за собой регулирование скорости парацеллюлярного транспорта веществ.
На примере некоторых питательных веществ предполагается 151 ], что их парацеллюлярный перенос является альтернативным, а скорее всего дополнительным процессом в общей цепи пищеварения. Так после употребления пищи, содержащей значительные количества глюкозы и аминокислот, напряженность плотного контакта уменьшается, что приводит к повышению процента всасываемости этих нутриентов парацеллюлярным путем. Более того активация натрий-зависимой системы активного транспорта глюкозы (Глют 1) в значительной степени увеличивает парацеллюлярные процессы.
Не являются исключением гормоны и нейротрансмиттеры (вазопрессин, ангиотензин II, эпинефрин), увеличивающие па- рацеллюлярную биодоступность ряда веществ. Аналогичные свойства отмечены и для цитокинов .
Определены некоторые клеточные и молекулярные механизмы регуляции действия белковых структур плотного контакта. Значительную активность по отношению к плотному соединению проявляют вторичные мессенджеры и протеинки- назы, определяя функциональное состояние его барьерной активности. Конечным этапом молекулярной регуляции является фосфорилирование белков плотного контакта и его сокращение или расслабление в системе актин-миозин микрофиламентов. Наиболее чувствительным звеном в общем процессе регулирования функции плотного контакта является фосфорилирование окклюдина. Очевидно с этим процессом связано становление и развитие структурных и барьерных функций плотного контакта.
Найдены и исследованы ингибиторы парацеллюлярного транспорта веществ. Они включают: хелатные комплексы иона кальция (Са2+), желчные кислоты, анионные суфрактанты, жирные кислоты (средней длины), эфиры жирных кислот, фосфорные эфиры.
В опытах на изолированных из аденокарциномы человека монослойных клеток Сасо-2 было показано, что ингибиторы активности плотного соединения действуют в различных концентрациях (от 0,2 цМ карнитинпальмитила до 20 цМ желчных кислот). Механизмы действия этих веществ все еще остаются не выясненными. Существуют различные предположения, которые касаются определенной группы ингибиторов. Все они суммированы в обзорной статье и их механизм действия разбит на несколько биохимических направлений: 1) активация фосфолипазы С; 2) влияние на каскад тирозинкиназа-фосфата- за (ингибирование тирозинкиназы неселективными ингибиторами фосфатазы); 3) увеличение концентрации АТФ.
В связи с обсуждаемой проблемой данной главы, пожалуй, наиболее сложным является вопрос взаимодействия молекул клеточной адгезии и плотного контакта. Межклеточная адгезия определяется в своей основе мембранными белками, принадлежащими к классу кадгеринов (Е, Р и N). Все они являются кальций-зависимыми трансмембранными гликопротеинами.
В их молекулярной структуре обнаружен внеклеточный домен, непосредственно участвующий в межклеточном связывании. Однако он не стимулирует формирование полноценного межклеточного соединения, поскольку для этого необходима и цитоплазматическая часть кадгерина, связывающаяся с внутриклеточными белками из группы катенинов .
В эпителиальных клетках были идентифицированы три ка- тенина (а, Р и у). Межклеточные каналы полностью открыты при внутриклеточной концентрации Са2+ ниже КГ7 моль/л и полностью закрыты при концентрации ионов 5-Ю-5 моль/л. В случае повреждения или гибели клетки, с биологической точки зрения, она должна быстро отсоединиться от соседней. При этом происходит значительное повышение внутриклеточной концентрации ионизированного кальция. Он может поступать в клетку через поврежденную мембрану, а также накапливаться вследствие невозможности поврежденной клетки откачивать Са2+ из цитозоля . В свою очередь, хелатирование внеклеточного Са2+ может привести к усилению активности внутриклеточных протеинкиназ с последующим ускорением дезинте- гративных процессов межклеточных соединений. И, наоборот, уменьшение, с одной стороны, парацеллюлярной проницаемости и дезинтеграции межклеточных контактов, с другой, осуществляется низкими концентрациями внеклеточных ионов кальция, ингибирующих активность протеинкиназ, в частности тирозинкиназы.
Любой биологический процесс имеет относительную норму и отклонение (патологию). Не является исключением и барьерная функция плотного контакта. Предполагается, что некоторые воспалительные процессы кишечника обусловлены чрезвычайно высокой степенью парацеллюлярной проницаемости этой ткани. Низкая проницаемость легочной эпителиальной ткани приводит к некоторым аллергическим реакциям .
В отдельных местах между клетками могут встречаться обширные межклеточные зоны со щелью между соседними клетками шириной 10-20 нм (рис. 6.3). В этой области к мембране со стороны цитоплазмы прилегают микрофиламен- ты диаметром 6,0 нм .
В условиях щелевого контакта (gap junction), ионы кальция могут играть важную роль в процессах связывания. Высокие концентрации ионов кальция приводят к «закрытию» щелей.
Структура щелевых контактов детально изучена с помощью электронной микроскопии. Оказалось, что эта область устлана глобулярными белковыми субъединицами, которые расположены таким образом, что образуют правильные полигональные структуры решетчатого типа с периодом 10 нм. Они образуют своего рода канал с внешним диаметром 8 и внутренним - 2 нм. Глобулярные белки в области щелевых контактов получили название коннексонов. Каждый коннексон состоит из шести субъединиц - коннексинов. Они принадлежат к над- семейству белков, обеспечивающих клеточную адгезию. В результате соединения двух коннексонов образуется канал, связывающий близлежащие клетки. Такие соединения у различных видов животных могут иметь различные свойства. В настоящее время установлены гены, кодирующие структуру коннексинов.
Щелевой контакт, включающий соответствующий канал диаметром 1,5 нм пропускает вещества, имеющие небольшую молекулярную массу (неорганические ионы, сахара, аминокислоты, нуклеотиды, витамины). Они практически непроницаемы для белков, нуклеиновых кислот и полисахаридов. Для АТФ и циклической АМФ отмечена возможность транспорта посредством щелевого контакта .
На наружной поверхности цитоплазматической мембраны находятся десмосомы - круглые, овальные и полусферические структуры, размер которых постоянен у разных клеток и равен в диаметре 0,2 нм (рис. 6.1, 6.5). Наряду с этим существуют клетки, лишенные десмосом. От десмосом вглубь цитоплазмы, каждой из контактирующих клеток на расстояние до 4 нм тянутся фибриллы.
Плотные контакты образуются путем точечного соединения мембран соседних клеток через трансмембранные белки клаудин
и окклудин
, встроенные рядами, которые могут пересекаться так, что образуют на поверхности скола как бы решетку или сеть.
Плотные контакты блокируют перемещение макромолекул, жидкостей и ионов между клетками, обеспечивая тем самым барьерную функцию эпителия и регуляцию транспорта веществ через эпителиальный пласт.
Плотные контакты соединяют клетки однослойных эпителиев, особенно железистых и кишечных (клетки выстилки жкт и дыхательной системы). Плотный контакт встречается между всеми типами однослойного эпителия (эндотелий, мезотелий, эпендима).
Плотные контакты препятствуют свободному перемещению и смешиванию функционально различных внутримембранных белков, локализующихся в плазмолемме апикальной и базолатеральной поверхностей клетки, что способствует поддержанию ее полярности.
Плотные контакты имеют вид пояска шириной 0,1-0,5 мкм, окружающего клетку по периметру (обычно у ее апикального полюса).
Для поддержания целостности этих соединений необходимы двухвалентные катионы Mg 2+ и Ca 2+ . Контакты могут динамично перестраиваться (вследствие изменений экспрессии и степени полимеризации окклудина) и временно размыкаться (например, для миграции лейкоцитов через межклеточные пространства).

Фокальные контакты
Встречаются у многих клеток и особенно хорошо изучены у фибробластов.
Они построены по общему плану со сцепляющими лентами, но выражены в виде небольших участков - бляшек на плазмолемме. В этом случае трансмембранные линкерные белки-интегрины специфически связываются с белками внеклеточного матрикса (например с фибронектином). Со стороны цитоплазмы эти же гликопротеиды связаны с примембранными белками, куда входит и винкулин, который в свою очередь связан с пучком актиновых филаментов. Функциональное значение фокальных контактов заключается как в закреплении клетки на внеклеточных структурах, так и создании механизма, позволяющего клеткам перемещаться.
Щелевые контакты
Щелевые контакты
– щель 2-4нм, состоят из белковых каналов обеспечивают прохождение веществ до 1кДа.
Коннексоны
– регулируемые каналы, состоят из 6 коннексинов
– белковые субъединицы М=26-54 кДа.
Каналы перекрываются при попадании в клетку Ca 2+ при повреждении. Обмен тимином через коннексоны при отборе гибридных клеток усложняет отбор - т.к. два коннексона соседних клеток образуют канал по которым тимин передается из клетки в клетку.
Через коннексоны передаются электрические сигналы и малые регуляторные молекулы (например, cAMP, InsP 3 , аденозин, ADP и ATP). Коннексины - нестабильные белки, живущие несколько часов.
Присутствуют практически во всех клетках.
Имеется 20 различных коннексинов у мыши и 21 у человека. Многие клетки образуют несколько видов коннексинов, которые способны полимеризоваться в различных комбинациях. Например, кератиноциты экспрессируют Cx26, Cx30, Cx30.3, Cx31, Cx31.1 и Cx43; гепатоциты - Cx26 и Cx32; кардиомиоциты - Cx40, Cx43 и Cx45. Некоторые коннексины могут заменять другие в случае мутаций. Гетеромерные коннексоны (состоящие из разных коннексинов) Cx26/Cx32 в клетках печени, Cx46/Cx50 в хрусталике и Cx26/Cx30 коннексоны в улитке уха.
Объединение шести коннексинов двух типов может образовывать 14 вариантов коннексонов, из которых может образоваться 142=196 различных вариантов каналов!
Различные типы коннексинов человека и мыши.
| человек | Cx23 | Cx25 | Cx26 | Cx30.2 | Cx30 | Cx31.9 | Cx30.3 | Cx31 | Cx31.1 | Cx32 | - | Cx36 | Cx37 | Cx40.1 | Cx40 | Cx59 | Cx43 | Cx45 | Cx46 | Cx47 | Cx50 | Cx62 |
| мышь | Cx23 | - | Cx26 | Cx29 | Cx30 | Cx30.2 | Cx30.3 | Cx31 | Cx31.1 | Cx32 | Cx33 | Cx36 | Cx37 | Cx39 | Cx40 | - | Cx43 | Cx45 | Cx46 | Cx47 | Cx50 | Cx57 |
Коннексины - политопные интегральные мембранные белки 4 раза пересекающий мембрану, имеющие две внеклеточные петли (EL-1 и EL-2), цитоплазматическую петлю (CL) с N-концом (AT) и C-концом (CT) вдающимися в цитоплазму.
Специфические N- и E-кадгерины обеспечивающие адгезию клеток, что способствует образованию каналов между соседними клетками.
Белки взаимодействующие с коннексонами Cx43: v-, c-src киназы, киназа С, MAP киназа, Cdc2 киназа, казеин киназа 1, киназа A, ZO-2, ZO-1, b-катенин, Дребрин, a-, b-тубулин, кавеолин-1, NOV, CIP85.
С коннексонами способны взаимодействовать различные белки, например, киназы, фосфорилирующие коннексины и меняющие их свойства, что может регулировать работу канала. С коннексонами
так же взаимодействют тубулины (белки микротрубочек), что может способствовать транспорт различных веществ вдоль микротрубочек непосредственно к каналу. Белок дребрин взаимодействует с коннексинами и с микрофиламентами, что указывает на взаимосвязь каналов и организации цитоскелета клетки.
Коннексоны могут закрываться при действии тока, pH, напряжения мембраны, Ca2+.
Десмосомы
Десмосомы
– соединяют клеточную мембрану с промежуточными филаментами, формируя сеть устойчивую к растяжениям.
Цитокератиновые филаменты
Десминовые филаменты
Пластинка прикрепления
иммеет дисковидную форму (диаметр ~0,5 мкм и толщиной 15 нм) и служит участком прикрепления к плазматической мембране промежуточных филаментов.
Состоит из белков - десмоплакин
, плакоглобин
, десмокальмин
.
Межклеточная щель
в области десмосомы шириной 25 нм заполнена белками десмоколлинами и десмоглеинами - Са 2+ -связывающие адгезивные белки, взаимодействующие с пластинками прикрепления.
Полудесмосомы
Полудесмосомы – прикрепляют базальную часть плазматической мембраны эпителиальных клеток к базальной мембране.
Септированные контакты
Плазмодесмы
Этот тип межклеточных связей встречается у растений. Плазмодесмы представляют собой тонкие трубчатые цитоплазматические каналы, соединяющие две соседние клетки. Диаметр этих каналов обычно составляет 20-40 нм. Ограничивающая эти каналы мембрана непосредственно переходит в плазматические мембраны соседствующих клеток. Плазмодесмы проходят сквозь клеточную стенку, разделяющую клетки.
Внутрь плазмодесм могут проникать мембранные трубчатые элементы, соединяющие цистерны эндоплазматического ретикулума соседних клеток.
Образуются плазмодесмы во время деления клетки, когда строится первичная клеточная оболочка. У только что разделившихся клеток число плазмодесм может быть очень велико (до 1000 на клетку), при старении клеток их число падает за счет разрывов при увеличении толщины клеточной стенки.
C помощью плазмодесм обеспечивается межклеточная циркуляция растворов, содержащих питательные вещества, ионы и другие соединения. По плазмодесмам могут перемещаться липидные капли Через плазмодесмы происходит заражение клеток растительными вирусами. Однако эксперименты показывают, что свободный транспорт через плазмодесмы ограничивается частицами с массой не более 800 Да.
Интердигитации
Интердигитации
- межклеточные соединения, образованные выпячиваниями цитоплазмы одних клеток, вдающимися
в цитоплазму других. За счет интердигитаций увеличивается прочность соединения клеток и площадь их контакта.
Эпителиальные ткани выполняют барьерную и транспортную функции, для этого они должны быть способны пропускать одни вещества и задерживать другие. Такую выборочную проницаемость успешно обеспечивают клеточные мембраны , однако между клетками остаются промежутки, через которые может проходить так называемый парацеллюлярный (параклеточный) транспорт (англ. Paracellular transport ). Роль плотных контактов заключается в том, чтобы ограничивать и регулировать параклеточную диффузию: они предотвращают протекание тканевой жидкости через эпителий, но при необходимости могут быть проницаемыми для ионов , небольших гидрофильных молекул и даже макромолекул . Также плотные контакты выполняют так называемую функцию «ограждения», они предотвращают диффузию компонентов мембраны в её внешнем слое, благодаря чему поддерживается разница в составе апикальной и базолатеральной мембран. Плотные контакты задействованы в сигнальных путях, регулирующих пролиферацию , поляризацию и дифференциацию эпителиальных клеток .
Аналогом плотных контактов у беспозвоночных являются септированные контакты .
Энциклопедичный YouTube
1 / 1
Jaundice - causes, treatment & pathology
Строение и молекулярный состав
Плотные контакты состоят из тонких лент, пересекающихся между собой, которые полностью опоясывают клетку и контактируют с аналогичными лентами на соседних клетках. На электронных микрофотографиях заметно, что в участках плотных контактов мембраны соприкасаются одна с другой или даже сливаются. Комбинация метода замораживания-скалывания с электронной микроскопией с высоким разрешением позволила установить, что плёнки плотных контактов построены из белковых частиц диаметром 3-4 нм, которые выступают с обеих поверхностей мембраны. Также в пользу того, что в образовании плотных контактов ключевую роль играют белки, свидетельствует деление клеток под действием протеолитического фермента трипсина .
Всего в состав тесных контактов входит около 40 различных белков, как мембранных, так и цитоплазматических . Последние необходимы для прикрепления актиновых филаментов, регуляции и сигнализирования .
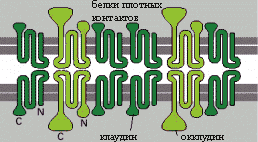
Мембранные белки
Мембранные белки плотных контактов можно разделить на две группы: те, которые пересекают мембрану 4 раза, и те, которые пересекают её только раз. Первая группа значительно распространена, в неё входят белки клаудины , окклюдины и трицеллюлин. Они имеют общие черты строения, в частности в них имеются четыре α-спиральных трасмембранных домена, N- и С-концы обращены к цитозолю , а домены, выступающие в межклеточное пространство, участвуют в гомо- или гетерофильных взаимодействиях с подобными белками на соседней клетке .
Основными белками плотных контактов являются клаудины (лат. claudo ). Их роль была продемонстрирована на примере мышей с отсутствующим геном клаудин-1, - в эпидермисе таких животных не формируются плотные контакты и они погибают в течение дня после рождения из-за обезвоживания вследствие интенсивного испарения . Клаудины также участвуют в формировании селективных каналов для транспорта ионов. В геноме человека есть гены по крайней мере 24 различных клаудинов, экспрессия которых происходит тканеспецифически .
Второе место по распространенности в плотных контактах занимают белки окклюдины (от лат. occludo - закрывать), они регулируют транспорт маленьких гидрофильных молекул и прохождение нейтрофилов через эпителий . Наибольшие концентрации третьего белка - трицеллюлина, наблюдаются в местах контакта трех клеток .
Цитоплазматические белки
Цитоплазматическая пластинка плотных контактов необходима для их присоединения к актиновым филаментам, регуляции сцепления клеток и параклеточного транспорта, а также для передачи сигналов от поверхности внутрь клетки. В её состав входят адаптерные, каркасные и цитоскелетные белки, а также элементы сигнальных путей (киназы , фосфатазы). Наиболее изучен белок цитоплазматической пластинки - ZO-1 , он имеет несколько доменов белок-белкового взаимодействия, каждый из которых обеспечивает контакт с другими компонентами, в том числе три PDZ-домена (англ. PSD95–DlgA–ZO-1 ) - с клаудинами и другими адаптерными белками - ZO-2 и ZO-3, GUK-домен (англ. guanylate kinase homology ) - с окклюдинами, а SH3-домен - с сигнальными белками .
С цитоплазматической стороной плотных контактов также ассоциированы комплексы белков PAR3/PAR6 и Pals1/PATJ, необходимые для установления полярности клеток и эпителиального морфогенеза .
Функции
Первые исследования функций плотных контактов привели к представлению, что это статические непроницаемые структуры, необходимые для того, чтобы ограничить диффузию веществ между клетками. Впоследствии было выяснено, что они избирательно проницаемы, к тому же их пропускная способность отличается в различных тканях и может регулироваться . Также установлена ещё одна функция плотных контактов: роль в поддержании полярности клеток путём ограничения диффузии липидов и белков во внешнем слое плазматической мембраны. В первом десятилетии 21 века также накоплены данные, свидетельствующие об участии этих структур в сигнальных путях, в частности, регулирующих пролиферацию и полярность .
Регулирование парацеллюлярного транспорта
Непроницаемость плотных контактов в большинстве водорастворимых соединений может быть продемонстрирована в опыте по введению гидроксида лантана (электронно плотный коллоидный раствор) в кровеносные сосуды поджелудочной железы . Через несколько минут после инъекции ацинарные клетки фиксируются, и из них готовятся препараты для микроскопии. В таком случае можно наблюдать, что гидроксид лантана диффундирует из крови в пространство между латеральными поверхностями клеток, но не может проникнуть через плотные контакты в их верхней части . Другие опыты показали, что плотные контакты также непроницаемы для солей. Например при выращивании почек собаки MDCK (англ. Madin-Darby canine kidney ) в среде с очень низкой концентрацией кальция, они формируют монослой , однако не сочетаются между собой плотными контактами. Через такой монослой могут свободно двигаться соли и жидкости. Если культуре добавить кальция, то за час формируются плотные контакты, и слой становится непроницаемым для жидкостей .
Однако не во всех тканях плотные контакты полностью непроницаемы, существуют так называемые неплотные эпителии (англ. leaky epithelia ). Например, эпителий тонкого кишечника пропускает в 1000 раз больше ионов Na + , чем эпителий канальцев почек. Ионы проникают через параклеточные поры диаметром 4 , селективные по заряду и размеру частиц, которые формируются белками клаудинами . Поскольку эпителии различных органов эксрессируют различные наборы клаудинов, то отличается и их проницаемость для ионов. Например, специфический клаудин, присутствуюий только в почках, позволяет проходить ионам магния в процессе реабсорбции .
Межклеточное пространство эпителия может быть проницаемым и для больших частиц, например, при повторении упомянутого опыта с гидроксидом лантана на ткани эпителия тонкого кишечника кролика можно наблюдать прохождение коллоидных частиц между клетками. Крупные молекулы транспортируются через специальные пути утечки (англ. leak pathway ) диаметром более 60 Å . Это важно, например, для процессов всасывания аминокислот и моносахаридов, концентрация которых в тонком кишечнике возрастает после еды достаточно для их пассивного транспорта .
Поддержание различия между апикальной и базолатеральной мембранами
Если в среду, контактирующую с апикальной частью монослоя MDCK-клеток, добавить липосомы , содержащие флуоресцентно меченые гликопротеины , некоторые из них спонтанно сливаются с клеточными мембранами . После этого флуоресценцию можно обнаружить в апикальной, но не в базолатеральной части клеток при условии целостности плотных контактов. Если же их разрушить, удалив из среды кальций , флуоресцентные белки диффундируют и равномерно распределяются по всей поверхности клетки .
Болезни, связанные с плотными контактами
С нарушением формирования тесных контактов связаны некоторые наследственные расстройства человека, например мутации в генах клаудина-16 и клаудина-19, которые приводят к гипомагниемии, вследствие чрезмерной потери магния с мочой. Мутации в гене клаудина-13 и трицеллюлина вызывают наследственную глухоту . Дисрегуляция некоторых белков плотных контактов связана с онкологическими заболеваниями, например экспрессия ZO-1 и ZO-2 снижается во многих типах рака. Компоненты тесных контактов также могут быть мишенями для онкогенных вирусов .
Некоторые вирусы используют мембранные белки плотных контактов для проникновения в клетку, в частности клаудин-1 является корецептором для вируса гепатита C . Другие вирусы присоединяются к белкам плотных контактов, чтобы разрушить барьер, отделяющий их от настоящих рецепторов на базолатеральной слое эпителиальных клеток, или неэпителиальных клетках .
Плотные контакты могут быть мишенью и для бактериальных патогенов , например Clostridium perfringens - возбудитель газовой гангрены , выделяет энтеротоксин (англ. ), действующий на внеклеточные домены мембранных клаудинов и окклюдинов, и вызывает протечки эпителия. Helicobacter pylori - возбудитель гастрита - вводит в клетки белок CagA, взаимодействующий с комплексом ZO-1-JAM-A, считается, что это помогает бактерии преодолеть защитный барьер желудочного эпителия
Плотный замыкающий контакт -- соприкасаются билипидные слои мембран соседних клеток. В области зоны плотных контактов между клетками не проходят практически никакие вещества.
Постоянные клеточные контакты скрепляют клетки в эпителиальном клеточном слое таким образом, что предотвращается перетекание даже малых молекул с одной стороны слоя на другую. Латеральная подвижность многих мембранных белков ограничена. Ограничение подвижности достигается с помощью барьеров, образованных при участии плотных контактов.
Клоны эпителиальных тканей (эпителии) функционируют в качестве избирательно-проницаемых барьеров, разделяющих жидкости с разным химическим составом по обе стороны слоя. В выполнении этой функции плотные контакты играют две роли.
Осуществляемый эпителиальными клетками трансклеточный транспорт (например, питательных веществ полости тонкого кишечника во внутриклеточную жидкость по другую сторону слоя) зависит от двух групп мембранных белков-переносчиков: одна находится на апикальной (обращенной в полость) поверхности клетки и активно транспортирует отдельные молекулы в клетку; другая находится на базолатеральной поверхности клетки и позволяет тем же молекулам покидать клетку путем облегченной диффузии. Для поддержания этого направленного транспорта не должно происходить перемещения апикальных белков-переносчиков на базолатеральную поверхность и наоборот.
Кроме того, промежутки между эпителиальными клетками должны быть скреплены таким образом, чтобы транспортированные молекулы не могли бы продиффундировать назад в полость через межклеточные промежутки.
Плотные контакты и выполняют эти две функции: барьеров для диффузии мембранных белков между апикальной и базолатеральной поверхностями и скрепления соседних клеток вместе так, что водорастворимые молекулы не могут перетечь на другую сторону слоя. При этом плотные контакты непроницаемы для макромолекул, а их проницаемость для малых молекул сильно варьирует в разных эпителиях. Эпителиальнные клетки могут временно модифицировать плотные контакты с тем, чтобы допустить увеличенный ток жидкости через бреши в контактных барьерах. Такой параклеточный транспорт особенно важен при абсорбции аминокислот и моносахаридов из полости тонкого кишечника.
Важнейшим элементом в структуре избирательно проницаемых барьеров эпителиальных и эндотелиальных являются плотные контакты. Избирательная проницаемость варьирует от ткани к ткани, пропуская или целые клетки и макромолекулы, или только протоны и ионы. Плотный контакт выглядит как пояс из переплетающихся скрепляющих нитей, который полностью окружает апикальный конец каждой клетки эпителиального слоя. Полагают, что скрепляющие нити состоят из длинных рядов специфических трансмембранных белков в каждой из двух взаимодействующих плазматических мембран, и которые (белки) соединяются напрямую друг с другом, что приводит к закупориванию межклеточного пространства. Интегральным мембранным белком плотного соединения оказался окклудин (взаимодействует с двумя цитоплазматическими белками, ZO-1 и ZO-2 (zonula occludence 1, 2). Их функция окончательно не ясна. Возможно, их роль заключается в локализации оккулдина в сайтах между апикальной и базолатеральной поверхностями клетки. Некоторые ассоциированные с цитоскелетом белки были также обнаружены в участках плотных контактов. Среди них зингулин, антиген и актин (по данным электронной микроскопии, актиновые филаменты состоят из двух цепей глобулярных молекул, диаметром 4 нм и образующих двойную спираль, на каждый виток которой приходится 13,5 молекулы). Эти цепи составляют основу тонких филаментов скелетных мышц, которые кроме актина содержат также несколько других белков; глобулярный актин имеет молекулярную массу около 42 кД. Он содержит одну полипептидную цепь, состоящую из 375 или 374 аминокислотных остатков; различия в аминокислотной последовательности у разных актинов, как в пределах одного вида, так и межвидовые, крайне незначительны. Они составляют не более 25 аминокислотных замен; в настоящее время у позвоночных животных различают 6 изоформ актина, в зависимости от изоэлектрической точки они делятся на 3 класса - альфа, бета и гамма; бета- и гамма-актины характерны для немышечных клеток, а альфа-актины - для мышечных). Ras играет определенную роль в регулировании функционирования плотных соединений. Таким образом, в клетках имеются, по-видимому, сходные механизмы построения и регуляции адгезионных структур, и эти механизмы тесно взаимосвязаны с изменениями в цитоскелете. Однако, каким образом перестройки цитоскелета влияют на процессы межклеточной адгезии, пока окончательно не ясно. Механизмы адгезии и межклеточной сигнализации тесно сопряжены с давно известным феноменом контактного торможения, природа которого до сих пор до конца не выяснена.
